NAD+作为细胞能量代谢的核心分子,其前体物质NMN(β-烟酰胺单核苷酸)和NR(烟酰胺核苷)一直是抗衰老研究的焦点。然而,日本富山大学团队最新发表于《Science Advances》的研究揭示了一个令人惊讶的发现:在小鼠模型中,这两种分子的代谢路径远比想象中复杂,肠道菌群在其中扮演着至关重要的角色。

研究团队采用同位素标记追踪、基因敲除模型和无菌小鼠等多种技术手段,系统解析了NMN和NR的代谢命运。实验结果显示,无论是口服还是静脉注射,这些前体物质最终都绕不开肠道菌群的"加工改造"。
①口服的NMN/NR仅有少量通过小肠直接吸收,超过90%进入大肠后被肠道菌群脱氨基转化为烟酸(NA),随后通过门静脉进入肝脏完成NAD+合成。
②静脉注射的NMN/NR同样会经历"肝胆循环":在血液中降解为烟酰胺(NAM)后,经胆汁分泌至肠道,再次被菌群转化为烟酸后重新吸收利用。
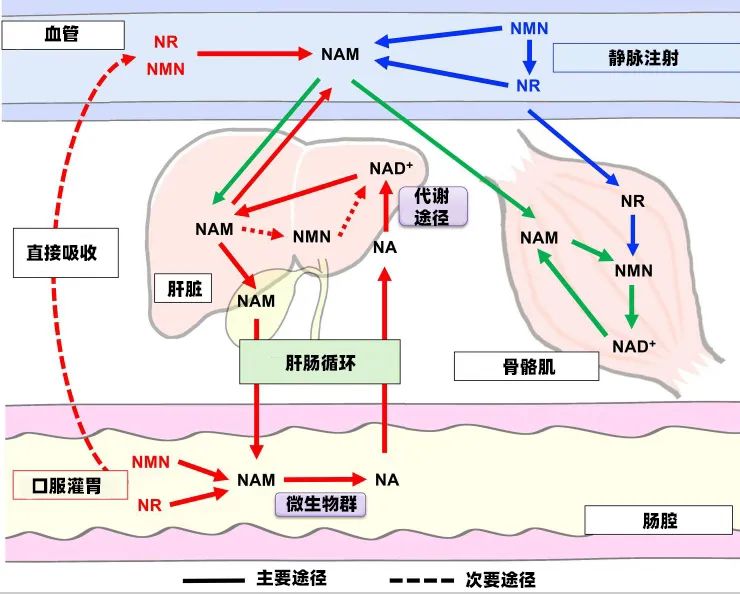
这种独特的代谢路径造就了组织间的显著差异。肝脏作为NAD+合成的"核心工厂",其水平提升完全依赖Preiss-Handler代谢通路,而骨骼肌则主要通过"补救途径"利用烟酰胺合成NAD+。这解释了为什么静脉注射NR能短暂提升肌肉NAD+水平,而口服效果甚微。
更深入的研究发现,这种宿主-微生物的协同进化具有重要生理意义。哺乳动物自身缺乏脱氨酶,肠道菌群的"代工"恰好弥补了这一代谢缺陷。同时,通过胆汁-肠道循环实现的"资源回收"机制,避免了过量烟酰胺经肾脏排泄造成的浪费。

总的来说,这项研究不仅改写了NAD+代谢的传统认知,更为理解衰老和代谢疾病提供了全新视角。虽然目前结论基于小鼠模型,但已有的人类临床试验数据暗示这可能是一种跨物种保守的代谢机制。
这些发现为未来开发更高效的NAD+干预策略指明了方向:或许需要更关注宿主-微生物组的协同作用,而非单纯增加前体物质的摄入。
本文内容转载自学术期刊,相关信息仅做分享学习,不代表任何医疗建议用途。如有侵权,请致信本文作者删除,本文观点不代表邦泰生物立场。