全球人口老龄化日趋显著。预计到2050年,65岁以上人口将达16亿,较2020年的7.8亿翻倍。伴随衰老,人体内脂肪会重新分布,异位堆积于肝脏、肌肉和骨骼等组织中。
现代生活中常见的久坐习惯和高脂饮食,进一步加剧了与年龄相关的代谢紊乱。NAD+(烟酰胺腺嘌呤二核苷酸)作为细胞能量代谢中的关键分子,广泛参与糖酵解、三羧酸循环和线粒体呼吸等过程。然而,NAD+水平会随年龄增长而下降。因此,促进NAD+生物合成,被认为有望缓解衰老过程中出现的多种生理功能衰退。
2025年1月,发表在《The Journal of Nutrition》杂志上的一项研究显示,补充NMN可通过提升小鼠体内NAD+水平,进而抑制HFD诱导的肥胖,改善糖脂代谢和骨骼肌功能,并减轻肾脏损伤。此外,NMN还降低了p16、白细胞介素1β和肿瘤坏死因子α等衰老与炎症相关标志物的水平,最终减轻与年龄和饮食相关的生理衰退。

△长期服用烟酰胺单核苷酸可减轻高脂饮食引起的衰老小鼠生理衰退
PART 01
NMN可减轻肥胖并延缓衰老
研究人员在小鼠饮用水中添加NMN(400 mg/kg体重)持续7个月观察其对HFD中年小鼠各个器官的影响,结果显示,长期服用NMN在干预4个月后降低了HFD小鼠的体重。通过磁共振成像分析小鼠的身体成分,发现NMN干预显著降低了小鼠的全身脂肪含量和肝脏脂肪含量,表明NMN 延缓了 HFD 引起的衰老过程。
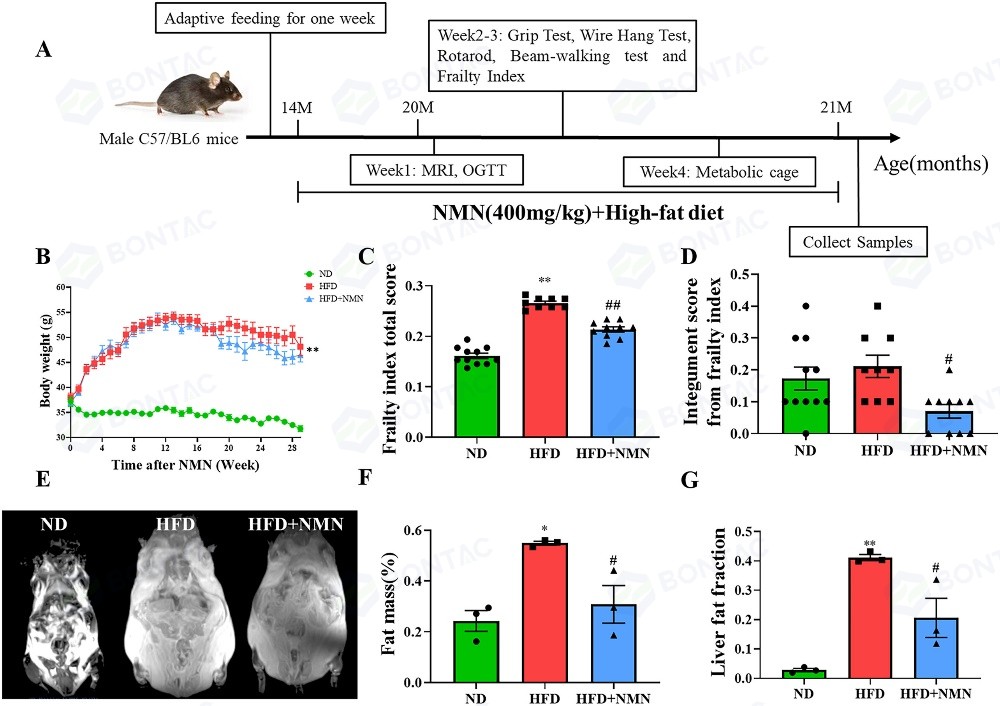
△图1 长期服用NMN可减轻HFD治疗小鼠的肥胖并延缓衰老
PART 02
NMN可增强能量代谢和身体活动
研究表明,经过7个月的高脂饮食(HFD)后,补充NMN能显著改善小鼠随之出现的能量代谢障碍和活动量下降。其机制在于,NMN干预不仅提升了耗氧量以增加整体能量消耗,还通过提高呼吸交换率,表明机体的供能模式从以脂肪酸为主转向更多利用葡萄糖。行为学观察进一步证实,与单纯接受HFD的小鼠相比,NMN治疗组小鼠在黑暗期间的身体活动量显著增加。这些结果共同表明,NMN给药可有效逆转由HFD引起的能量代谢失调和自发活动减少。
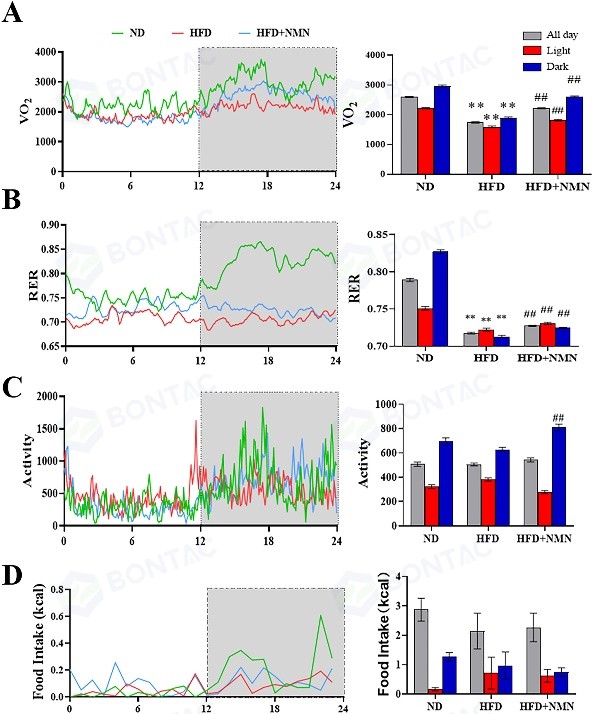
△图2 长期服用 NMN 可增强HFD 治疗小鼠在黑暗时间内的能量代谢和身体活动
PART 03
NMN可改善血糖和血脂状况
通过口服葡萄糖耐量试验评估发现,长期NMN治疗显著增强了高脂饮食(HFD)小鼠对葡萄糖负荷的耐受性。在血脂水平方面,检测结果显示NMN给药能显著降低HFD诱导升高的甘油三酯(TG)和低密度脂蛋白(LDL)胆固醇水平,并对总胆固醇(TC)水平略有改善。
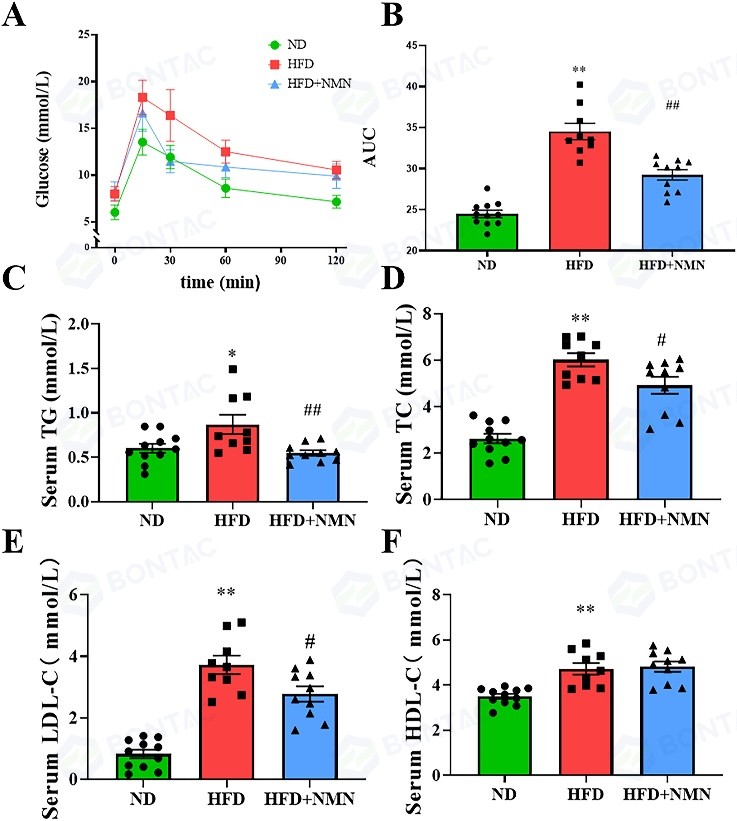
△图3长期服用 NMN 可改善HFD 治疗小鼠的血糖和血脂状况
PART 04
NMN可改善HFD治疗小鼠外周组织的病理变化
为进一步评估长期NMN干预对器官组织的影响,研究人员进行了组织病理学分析。在脂肪组织中,与正常饮食(ND)小鼠相比,高脂饮食(HFD)小鼠的脂肪细胞显著增大、形态异常且胞内脂滴空泡增多;而NMN干预显著减小了脂肪细胞的横截面积,改善了脂肪细胞排列形态。在肾脏组织中,NMN干预不仅缓解了HFD引起的肾小球萎缩和肾小管间质炎性细胞浸润,还显著降低了组织的纤维化程度。
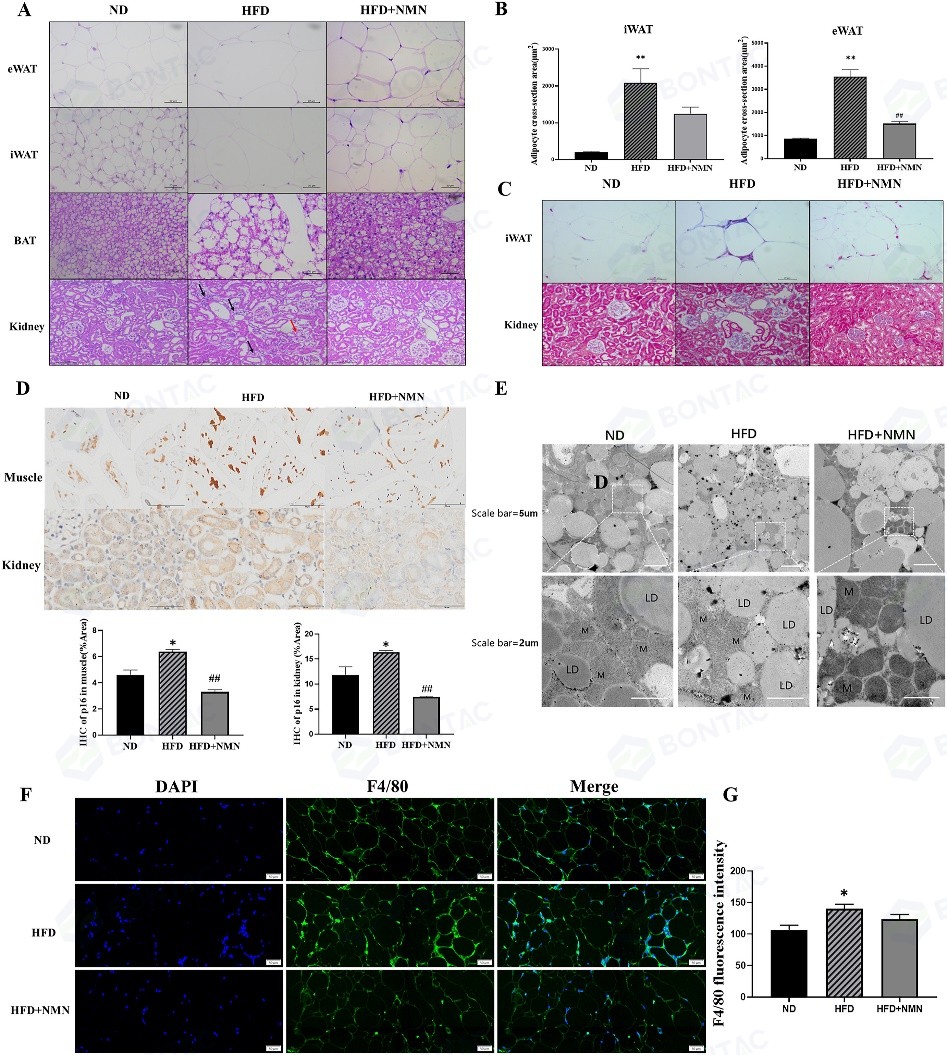
△图4 长期服用NMN可改善HFD治疗小鼠外周组织的病理变化
PART 05
NMN可改善骨骼肌功能障碍
研究人员使用悬挂线测试、转棒试验评估了 NMN 干预对骨骼肌功能的影响。结果发现,与正常饮食(ND)组相比,高脂饮食(HFD)小鼠在两个测试中的停留时间均显著缩短,表明其肌肉力量和协调性下降;而长期NMN干预则显著增加了HFD小鼠的停留时间。相应地,腓肠肌的H&E染色形态学分析显示,NMN处理增大了肌纤维的横截面积并使其排列更为紧密。这些行为学和形态学证据共同表明,NMN能有效改善HFD小鼠的骨骼肌功能。
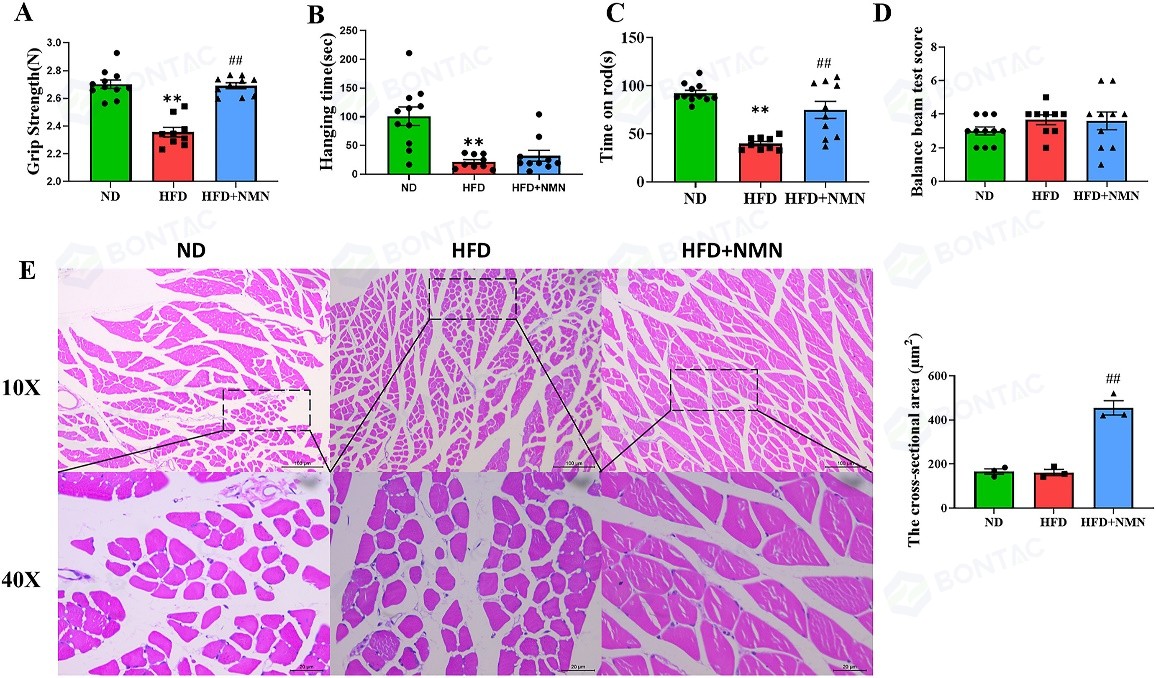
△图 5 长期服用 NMN 可改善 HFD 治疗小鼠的骨骼肌功能障碍
PART 06
NMN对HFD小鼠外周器官SIRT1/SIRT3活性的影响
在证实NMN可逆转高脂饮食(HFD)导致的小鼠血液NAD+水平降低的基础上,研究人员进一步探究了NMN是否可以激活NAD +依赖的去乙酰化酶,如SIRT1和SIRT3。蛋白印迹(WB)结果显示,长期NMN干预不仅能增加高脂饮食小鼠脂肪和骨骼肌组织中的SIRT1表达,还能提高骨骼肌中的SIRT3蛋白水平。
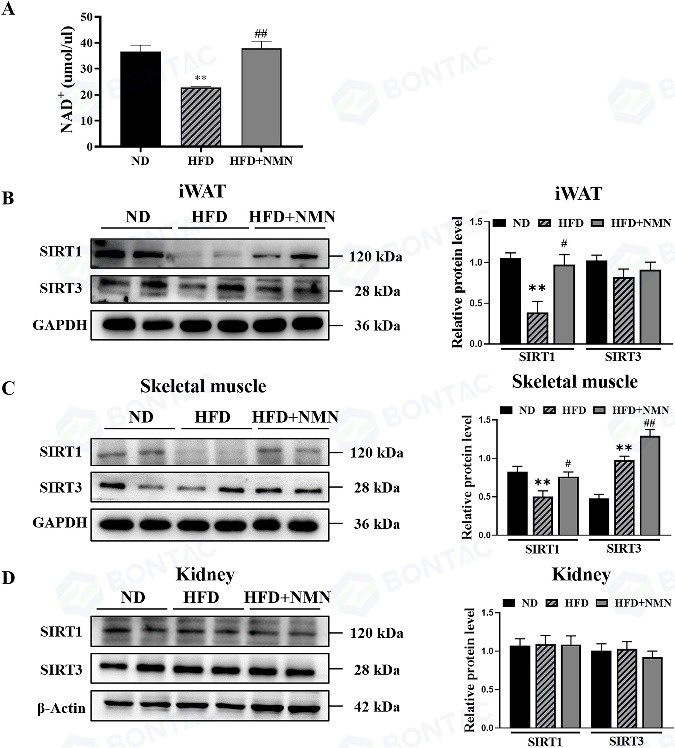
△图6 长期服用 NMN 对 HFD 处理小鼠外周器官 SIRT1/SIRT3 活性的影响。
总结
本研究证实,NMN作为一种生物活性分子能有效缓解高脂饮食小鼠的多器官生理衰退,包括改善代谢、减少组织病理损伤和增强肌肉功能,为开发基于NMN的抗衰老策略开辟了新途径。
参考文献:
Zhou, Ao-Jia et al. “Long-Term Administration of Nicotinamide Mononucleotide Mitigates High-Fat-Diet-Induced Physiological Decline in Aging Mice.” The Journal of nutrition vol. 155,1 (2025): 237-249. doi:10.1016/j.tjnut.2024.10.017